冻干技术虽能显著提升单抗、疫苗等生物药的长期稳定性,但传统复溶方法依赖医护人员手动操作,步骤繁琐且易出错(如针头堵塞、剂量不准)。因此随着包材形式的法制,出现了双腔卡式瓶自动注射器(Autoinjectors with dual-chamber cartridges ,AIDCs),它是种一次性、可自行给药的注射装置,有助于冻干产品的自动复溶重构和注射。
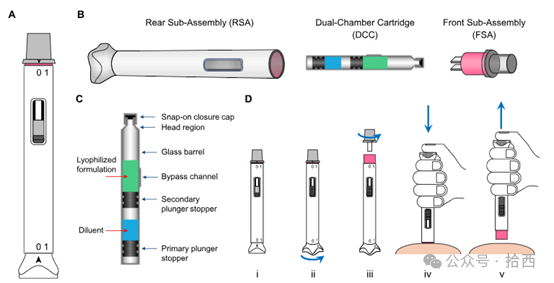
AIDC的核心设计主要由三个组装部件构成:
后部组件(Rear Sub-Assembly ,RSA):预压缩弹簧提供动力,推动药液。
双腔卡式瓶(Dual-ChamberCartridge,DCC):
- 前腔:冻干药物(Lyophilized Drug Cake);
- 后腔:稀释液(Diluent);
- 旁路通道(Bypass Channel):复溶时稀释液绕行至前腔的关键通道。
前部组件(Front Sub-Assembly,FSA):集成针头,直接注射。
当患者使用时,只需要进行3个步骤的操作:旋转激活→去除针帽→按压注射,全程无需手动混合!
但虽然新兴的AIDC通过集成双腔卡式针筒(DCC)和弹簧驱动机构,将复溶、排气、注射整合为一步操作,极大提升了患者便利性。然而,AIDC的设计涉及复杂的多物理场耦合(如流体动力学、固体力学、气体压缩),其性能受众多参数影响。
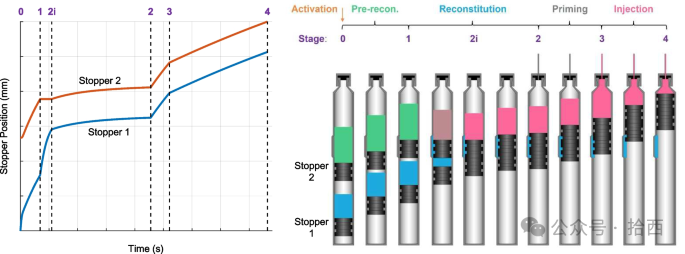
Merck 和 Veryst Engineering, LLC 研究团队尝试通过数学建模揭示AIDC内在的工作原理,并为设计决策提供量化依据。将AIDC的工作流程分解为五个阶段(初始态Stage0、复溶启动Stage1、复溶完成Stage2、排气Stage3、注射Stage4),针对每个阶段建立了基于牛顿力学和流体动力学的常微分方程(ODEs
模型的关键创新点包括:
胶塞摩擦力(Stopper friction)的实验标定:通过ADMET力学测试仪实测胶-针筒摩擦力的速度依赖性,拟合出幂律方程,解决了传统理论模型难以预测橡胶-玻璃界面摩擦的问题;
组织背压(Tissue Back-Pressure)的简化建模:基于离体皮下组织实验数据,提出线性背压模型,首次量化了注射介质(空气vs.组织)对AIDC性能的影响;
最大稀释液体积的解析解:通过理想气体定律和力学平衡,推导出避免旁路泄漏的临界体积公式,为卡式针筒设计划定安全边界。
模型的验证通过严格的对比实验完成:
药液粘度(1.3~24 cP):1.3 cP(低粘度模拟生理盐水)、5 cP、10 cP、24 cP(高粘度模拟单抗)
针头规格(23G~29G):23G(内径0.33 mm)、25G(0.26 mm)、27G(0.21 mm)、29G(0.18 mm)。
稀释液体积(0.5~1.5 mL):0.5 mL、1.0 mL、1.5 mL(覆盖常见剂量范围)。
发现不同参数组合的性能,存在不同的差异影响,比如:
针头选择:模型揭示高粘度药液(如24 cP)使用29G针时,注射时间比23G针长5倍,直接支持了“大分子药物优选粗针”的临床决策;
润滑剂优化:摩擦力模型显示,硅油层厚度变化可能导致注射时间波动±15%,提示生产工艺需严格控制润滑剂涂布;
患者体验预测:通过模拟不同粘度药液的流量曲线,可提前识别可能导致疼痛的骤停或脉冲式注射(如弹簧力衰减过快)。
通过对测量实际注射时间并与模型预测的对比。结果显示,模型对低粘度药液的预测误差<9%,高粘度药液误差<12%,且在流量曲线动态趋势、组织背压影响等细节上均与实验高度吻合。这一精度水平表明,该模型已具备工程实用性,可帮助研发团队在早期设计阶段快速进行评估。
有助于推动AIDC从“经验驱动设计”转向“模型驱动设计”。这不仅可缩短产品开发周期,还能通过虚拟筛选降低材料成本。此外,模型的模块化框架允许未来集成更多物理效应(如冻干饼溶解动力学、针头插拔力),为下一代智能注射器(如电动反馈调节AIDC)奠定理论基础。
总之,这项研究通过跨学科方法(制药工程+应用数学+实验力学),构建了一个兼具预测精度和工程实用性的AIDC模型,其价值不仅在于解决冻干药物自我给药的现实难题,更在于提供了一套可推广的“仿生建模”方法论——通过分解复杂生物医疗器械的工作流程,用物理学定律和实验数据共同约束数学模型,最终实现从“黑箱操作”到“透明化设计”的跨越。未来,随着个性化药物(如mRNA疫苗、CAR-T细胞疗法)的普及,此类模型或将成为连接药物特性、器械设计与患者体验的“数字桥梁”,助力精准医疗时代的到来。
作者:Shengyi
来源:拾西
公众号日期:2025年7月25日
为帮助审核人员更快处理,请填写举报原因:
为帮助审核人员更快处理,请填写举报原因:
